3月12日,美国强生公司宣布,美国FDA已经授予双特异性疗法JNJ-6372突破性疗法认定,用于治疗接受铂类化疗期间或之后疾病进展的携带EGFR外显子20插入突变的转移性非小细胞肺癌(NSCLC)患者。
这一突破性疗法认定是基于一项开放标签,多中心1期临床研究数据的支持。这项研究评估JNJ-6372单药治疗和联合lazertinibi治疗成人晚期NSCLC的安全性、药代动力学和初步疗效。
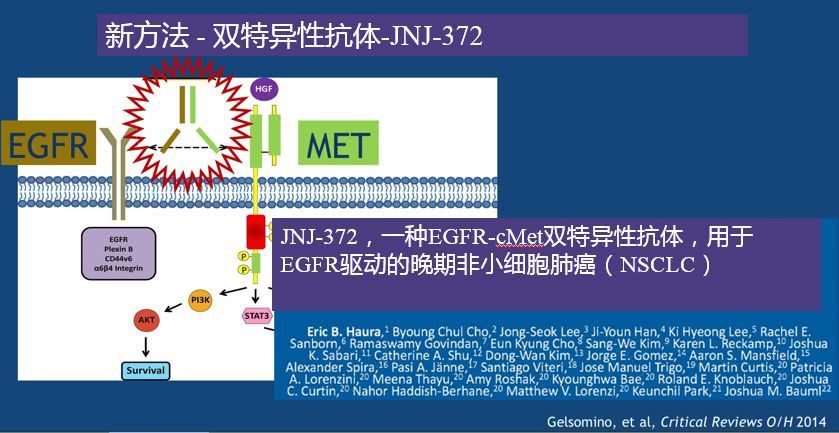
JNJ-6372是一种
EGFR-cMet双特异性抗体
JNJ-6372是美国强生公司与丹麦Genmab公司合作,基于DuoBody平台研发的靶向EGFR以及cMet的人源化双特异性抗体。JNJ-6372能够同时抑制EGFR以及cMet的磷酸化,以及下游信号的激活,并且有较强的ADCC(抗体依赖性细胞介导的细胞毒作用)。
JNJ-6372临床试验方案
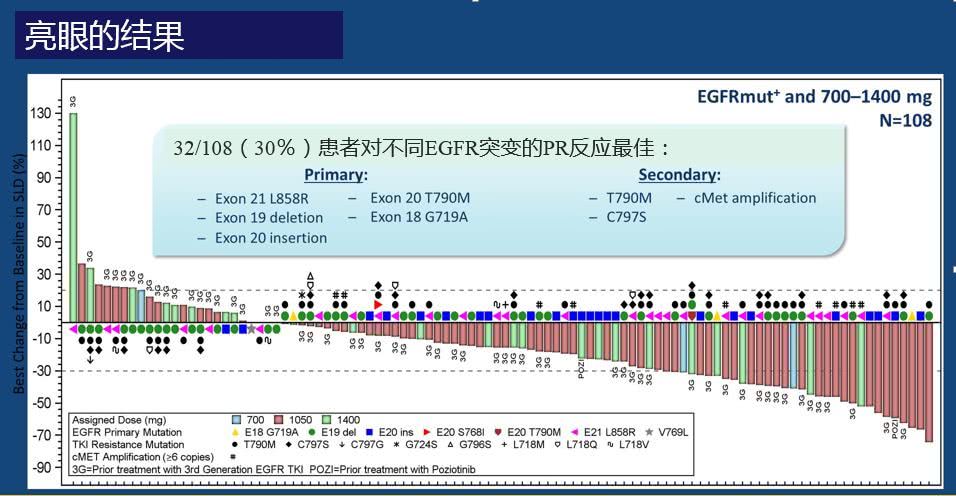
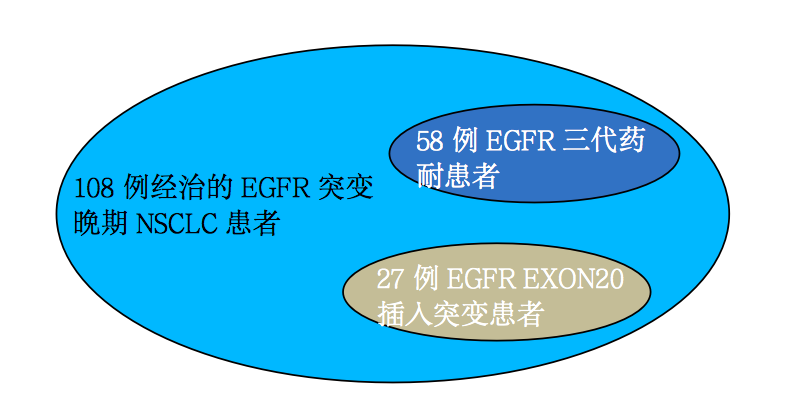
JNJ-6372临床研究纳入了108例经治的EGFR突变晚期NSCLC患者接受JNJ-6372治疗。其中包括了58例EGFR三代药耐药患者,27例EGFR EXON 20插入突变患者。如下图所示:
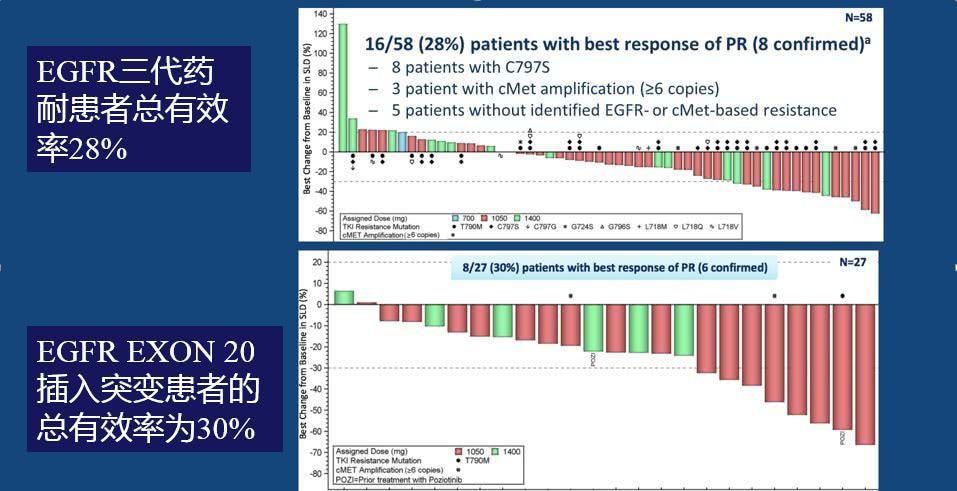
58例EGFR三代药耐药患者的总有效率为28%,16例肿瘤部分缓解患者里包括了8例C797S突变,3例MET扩增,5例其它耐药机制(非EGFR耐药突变或MET扩增)。27例EGFR EXON 20插入突变患者的总有效率为30%,8例肿瘤部分缓解患者里包括了1例波齐替尼耐药患者。
其中,有一些常见不良反应是:输液反应、乏力、血白蛋白减少、头晕、食欲下降等。JNJ-6372耐受性良好,9%患者发生3级以上药物相关不良反应,其中只有1例4级脂肪酶升高,4%的患者减量,8%的患者因不良反应终止治疗,没有患者因不良反应死亡。
优异的疗效数据
JNJ-6372在后线治疗中,ORR达到了30%,并且疗效遍及各种EGFR亚型。这些患者包括C797S突变,MET扩增,既往对奥希替尼耐药。
对EGFR20ins患者进行亚组分析,JNJ-6372的DCR居然达到100%!ORR为30%。如此漂亮的数据给难治的20ins患者带来新希望。另外,在这些人群中有2例是对波奇替尼耐药的患者,用JNJ-6372治疗达到了部分缓解PR及疾病控制SD。
总的来说,JNJ-6372在不同的EGFR突变亚型都展现了疗效,包括目前临床急需解决的C797S突变、MET及20ins,并且耐受性良好(≥3级AE发生率只有9%)。